IVDD und IVDR - Fragen und Antworten
Auf dieser Seite haben wir für Sie die häufigsten Fragen zur IVDR zusammengefasst.
Haben Sie weitere Fragen? Sie möchten Unklarheiten auf den Grund gehen? Dann wenden Sie sich gerne an Ihren Außendienstmitarbeiter, den Support unter der E-Mail support@chromsystems.com oder eine allgemeine Anfrage auf der Webseite.


Was sind IVDD und IVDR und worin unterscheiden sie sich?
In-vitro Diagnostika (IVD) unterlagen bisher der so genannten EU-Richtlinie 98/79/EG (IVDD). Die in der IVDD definierten Anforderungen wurden von den EU-Mitgliedsstaaten in ihren nationalen Gesetzen umgesetzt. Diese bisherige Richtlinie wurde durch die neue EU-Verordnung über in-vitro-Diagnostika (IVDR) ersetzt und trat am 26. Mai 2017 in Kraft. Da es sich nicht um eine Richtlinie, sondern um eine EU-weite Verordnung handelt, galt diese unmittelbar in allen Mitgliedsstaaten der EU.
Die wesentlichen Veränderungen mit der IVDR sind unten zusammengefasst:
Dokumentation
Strengere Anforderungen an die Dokumentation, insbesondere bei der technischen Dokumentation und der Überwachung nach dem Inverkehrbringen (Post-market surveillance)
Klassifizierung
Neue Klassifizierung: Klasse A (niedriges Risiko) > Klasse D (hohes Risiko)
Klinische Evidenz
Strengere Anforderungen an die klinische Evidenz
Sampling Process
Neues Verfahren für die Probenahme für IVD-Produkte auf dem Markt und Überprüfung der technischen Dokumentation
Neue Anforderung
Benennung eines Hauptverantwortlichen im Unternehmen für die Einhaltung der regulatorischen Vorschriften (PRRC)
Benannte Stelle
Verstärkte Überwachung der Unternehmen durch die benannte Stelle
UDI
Unique Identification Number (UDI) für jedes Medizinprodukt
EUDAMED
Europaweite Datenbank für erhöhte Transparenz und Rückführbarkeit
Was bedeuten die CE und IVD-Kennzeichnung beispielsweise auf den Flaschen?
Das CE-Symbol z.B. auf einem Etikett oder einer Arbeitsvorschrift ist kein Qualitätssiegel, sondern eine Kennzeichnung, die nur durch den Hersteller oder seinen Bevollmächtigten aufzubringen ist. Es bringt zum Ausdruck, dass es die Anforderungen der EU für in-vitro Diagnostika erfüllt.
Bei CE-Konformität durch die benannte Stelle wird zusätzlich die jeweilige vierstellige Nummer angegeben.
Das IVD Zeichen am Produkt ist kein Zertifikat, sondern zeigt lediglich, dass es sich um ein „In-vitro-Diagnostikum“ handelt, ein Medizinprodukt, das als Reagenz, Kalibrator, Kontrollmaterial, Kit, zur In-vitro-Untersuchung von aus dem menschlichen Körper stammenden Proben, einschließlich Blut- und Gewebespenden zu diagnostischen Zwecken bestimmt ist.
Welche Termine gibt es bei der IVDR für die Hersteller?
Hier sind zunächst zwei Fälle zu unterscheiden:
Neue oder modifizierte Produkte
Alle ab Mai 2022 entwickelten und auf den Markt gebrachten Produkte sowie Assays mit signifikanten Änderungen müssen mit der IVDR konform sein. Dies gilt völlig unabhängig von der Produkt-Klasse.
Existierende Produkte
Seit Anfang des Jahres sind neue Übergangsfristen (Verordnung 2022/112/EU) für existierende Produkte beschlossen worden, die von der Klassifizierung des Produkts abhängig ist.
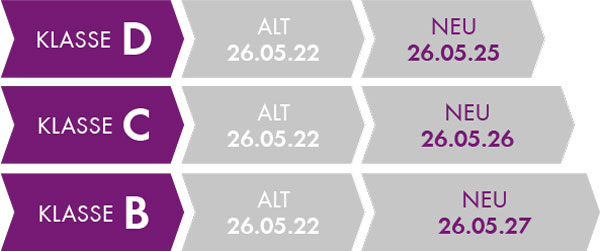

Übergangsfristen der Klasse B bis Klasse D-Produkte.
Wichtig!
Im Labor existierende Produkte dürfen nach dem Mai 2022 weiterhin legal eingesetzt werden, da sie bereits durch Chromsystems erstmalig in Verkehr gebracht worden sind.
Bei Klasse A gibt es keine Übergangsfrist, nur bei A steril ist es Mai 2028. Eine Ausnahme stellen Produkte dar, die bereits unter der IVDD ein Zertifikat hatten. Z.B. Newborn Screening Assays zur Bestimmung der Phenylketonurie. Hier gilt eine Übergangsfrist bis zum 26. Mai 2025. Chromsystems bietet IVD-Produkte der Klasse B und C an. Beispiele:
Klasse B
Crosslinks, Porphyrine, Homocystein, TDM (exkl. Immunsuppressiva), DoA und Arbeitsmedizin, Vitamine, CDT, ETG, Glu, MDA und Q10
Klasse C
Biogene Amine, Newborn Screening, Immunsuppresiva, Steroide, Cortisol, Aminosäuren-Analytik in Plasma und Urin
Sind alle Produkte von Chromsystems ab Mai 2022 IVD-konform?
Grundsätzlich behalten wir trotz der verlängerten Übergangszeiten den Fokus auf der Umsetzung der IVDR. Wir arbeiten mit Hochdruck daran, weitere Produktereihen schnellstmöglich in die IVDR-Konformität zu überführen.
Da eine Selbstzertifizierung für Klasse B und C-produkte nicht mehr möglich ist, sind die Hersteller von den benannten Stellen abhängig. Daher findet eine sukzessive Umstellung aller Produkte statt.
Wichtig!
Konformität und Verfügbarkeit aller Chromsystems-Produkte ist aufgrund der Übergangsfristen in jedem Fall gewährleistet.
Wer ist für Chromsystems die benannte Stelle?
Die benannte Stelle ist der TÜV-Süd Product Service GmbH, der mit der entsprechenden Kennnummer CE0123 auf den jeweiligen Etiketten ausgewiesen ist.
Was ist der aktuelle Stand bei Chromsystems?
Als IVD-Hersteller haben wir enorme Anstrengungen unternommen, die Anforderungen der neuen IVD-Verordnung (IVDR (EU) 2017/746) gesetzeskonform umzusetzen. Dazu gehören umfangreiche Investitionen in Ressourcen im regulatorischen Umfeld. Grundsätzlich behalten wir trotz der verlängerten Übergangszeiten den Fokus auf eine möglichst rasche Umsetzung der IVDR.
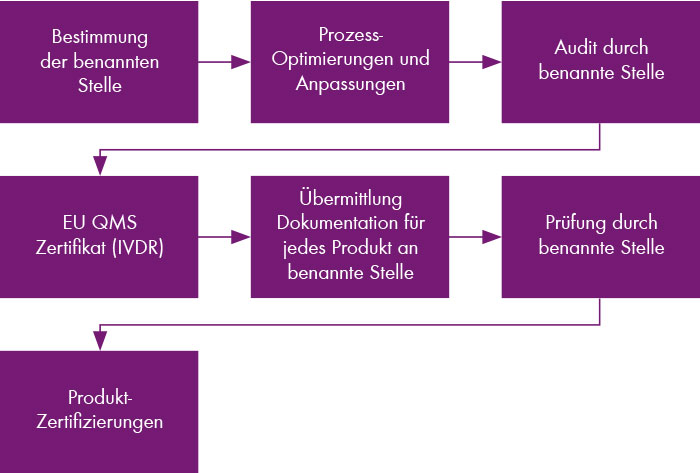
Aktuell sind einige, aber nicht alle Produkte IVDR zertifiziert. Hintergrund ist, dass trotz enger Zusammenarbeit und Abstimmung mit der benannten Stelle die Anforderungen der IVDR komplex und umfangreich sind.
In ersten Vor-Ort—Audits wurden die Gesamtprozesse des Unternehmens sowie erste Produkte auditiert. Die Zertifizierung des Unternehmens sowie von fünf Assays ist im Juli 2022 erfolgt. Aktuell wird die Dokumentation für alle weiteren Produkte sukzessive vorbreitet und an die benannte Stelle übermittelt. Chromsystems nutzt die Umstellung aber auch dazu, um Produkte zu optimieren.

Muss ich mit Lieferverzögerungen aufgrund der Umstellung auf IVDR rechnen?
Nein. Im vorgegebenen Rahmen der neuen IVD-Regularien ist bei Chromsystems-Produkten mit keinen Lieferproblemen zu rechnen.
Da vor der Zertifizierung hergestellte Produkte je nach Klassifizierung drei Jahre oder länger verwendet werden können, kann es sein, dass Sie in der Übergangsphase bis Mai 2028 IVDR und IVDD-Produkte parallel erhalten werden. Es kann sein, dass die Herstellung von einzelnen Bestandteilen teilweise vor und teilweise nach Upload der Tech Doku zur benannten Stelle erfolgt und sich deshalb CE und CE0123 gekennzeichnete Produkte in einer Lieferung befinden. Da sich jedoch Zusammensetzung und Eigenschaften der Produkte nicht ändern, können diese uneingeschränkt miteinander kombiniert und verwendet werden.
Darf ich IVDD Kits nach Mai 2022 in meinem Labor offiziell und konform anwenden?
Ja. Im Labor existierende Produkte dürfen nach dem Mai 2022 weiterhin legal eingesetzt werden, da sie bereits in Verkehr gebracht worden sind.
Auch wenn einige Produkte in der Übergangszeit nicht mit dem neuen CE-IVDR-Zertifikat versehen sein werden, können sie dennoch in der diagnostischen Routine als IVD/CE innerhalb des zulässigen Geltungsbereichs verwendet werden, da sie sich bereits in der Handelskette befinden und erstmalig in Verkehr gebracht wurden. Diese Produkte werden verfügbar sein, bis alle Produktgruppen von den benannten Stellen zertifiziert sind. Unsere Produkte können bis zum Ende der Haltbarkeit verwendet werden.
Werden alle Kits in die neue IVDR überführt, und wenn ja, wann ist mein Kit soweit?
Bei Chromsystems werden nach aktuellem Stand alle Kits in die neue IVDR überführt; und zwar innerhalb der von der IVDR erlaubten Übergangsfristen.
Wir stellen indes sicher, dass alle Produkte lückenlos verfügbar sein werden. Eine genaue Angabe, wann welcher Kit zertifiziert ist, kann derzeit nicht gegeben werden.
Trotz enger Zusammenarbeit und Abstimmung mit der benannten Stelle sind die Anforderungen der IVDR so komplex und umfangreich, dass die Nennung von Zeiträumen für die Umstellung einzelner Kits aktuell nicht möglich ist.
Wann muss ich im Labor die IVDR umsetzen?
Laboratorien müssen sich grundsätzlich an die ISO 15189 halten. Der Anwender muss die IVDR nur dann umsetzen, wenn er Lab-Developed Tests (LDTs) einsetzt. Mit der Verordnung 2022/112 wurde die Übergangsfrist für diese Vorgehensweise auf Mai 2024 verlängert.
Inwieweit sind die Kits im Neugeborenen-Screening eine Besonderheit? Sind sie schon aufgrund der CE0123-Markierung bereits IVDR-konform?
Die Assays für das Neugeborenen-Screening (Best. Nr: 55000/57000) waren nach der IVDD so eingestuft, dass das Konformitätsbewertungsverfahren durch eine benannte Stelle erfolgen musste. (nach Anhang II als Klasse B Produkt eingestuft und damit Konformität nach Anhang IV der IVDD). Diese Produktreihen waren daher auch schon zuvor von einer Selbstzertifizierung ausgenommen und wurden grundsätzlich durch den TÜV Süd zertifiziert - sind also auch schon in der Vergangenheit sehr ähnlich wie es von der IVDR verlangt wird, behandelt worden. Aufgrund der TÜV-Zertifizierung war auf diesen Produktetiketten schon immer die CE0123 abgedruckt.
Diese Produkte sind bis zum 25.5.2025 vom TÜV zertifiziert und dürfen auch so verwendet und verkauft werden.
Woran erkenne ich, dass das Produkt IVDR zugelassen ist?
Ein IVDR zugelassenes Produkt ist mit Ausnahme der Neugeborenen-Kits anhand der Kennzeichnung CE0123 zu erkennen, die auf den Etiketten und in der Arbeitsvorschrift zu finden sind. Darüber hinaus sind die CE-Erklärungen auf der Webseite zum Download verfügbar und zeigen, ob ein Produkt noch unter IVDD oder bereits unter der IVDR auf den Markt gebracht wird.
Welche Chromsystems-Produkte sind schon IVDR-zertifiziert?
Was kann ich tun, wenn ich weitere Fragen habe?
Bei weiteren Fragen, wenden Sie sich bitte an Ihren Außendienstmitarbeiter, den Support unter support@chromsystems.com oder über eine allgemeine Anfrage der Webseite.
Letzte Aktualisierung am 31. Oktober 2022
