Was bringt die IVDR für Hersteller und Labore?
Herausforderung und Chance der neuen Regulierung von Diagnostik
Im Vergleich zu Unternehmen in Pharma und Medizintechnik hatten Diagnostik-Hersteller und medizinische Labore deutlich weniger Aufwand im regulatorischen Bereich. Seit Mai 2017 ist nun die neue IVDR in Kraft und ab Mai 2022 verpflichtend. Diese neue europäische Verordnung reguliert die Herstellung von Medizinprodukten und In-vitro-Diagnostika. Sie ist um ein vielfaches strenger und mit erheblich größerem Aufwand verbunden.
So konnten IVD-Hersteller in der Vergangenheit etwa 80 bis 90 Prozent ihrer CE-Produkte selbst deklarieren, und dabei ohne Prüfung der erforderlichen Dokumente und Unterlagen. Diese Kontrolle geschah in der Regel im Rahmen der üblichen Audits der Zertifizierer. Auch die Anzahl der Zertifizierer wird deutlich vermindert, zur „Benannten Stelle“ aufgewertet und strenger reguliert.
Fachleute prognostizieren deshalb eine Umstrukturierung in IVD-Markt und Laborumfeld. Ein Symposium der AWMF im Februar 2020 in Lübeck (Link 1) hat es noch einmal bestätigt: rund um die neue IVDR herrscht große Unsicherheit bei den Laboratorien. „Es mangelt an klaren Antworten und offiziellen Stellungnahmen. Man weiß nicht so recht was das für unser Labor zu bedeuten hat und vor allem wie wir uns da bestmöglich vorbereiten können. Das ist eine durchaus beunruhigende Situation“, war ein Fazit eines Symposium-Teilnehmers. „Es fehlen Stellungnahmen und Anweisung von entsprechenden Stellen, um die neuen Regulierungsaufgaben für die medizinischen Labore transparent und einheitlich aufzuzeigen“.


Dr. Ralf Fischer, Head of Regulatory Affairs bei Chromsystems
„Aber auch wir als Hersteller müssen uns großen Herausforderungen stellen, um der neuen IVDR 2017 gerecht zu werden“, meint Dr. Ralf Fischer, der Verantwortliche für Regulatory Affairs bei Chromsystems und mit der Umsetzung der neuen IVDR im Unternehmen betraut. Ein noch nicht abschließend überschaubarer regulatorischer, personeller und deutlich finanzieller Mehraufwand zur Umsetzung der geforderten Regularien beschäftigt die Unternehmen schon jetzt.
Das Regulatorische Framework
Bis dato ist es bei Chromsystems selbstverständlich, die neu entwickelten Methoden umfassend und sorgfältig zu validieren. Die Konformität der dahinterstehenden Prozesse werden regelmäßig über externe Audits überprüft, die die benannten Stelle vor Ort durchführt. „Wir haben sehr viele Audits unter anderem von TÜV Süd, von der amerikanischen Gesundheitsbehörde FDA, der koreanischen Behörden und der Brasilianischen ANVISA hinter uns, die unsere Konformität nach allen individuellen und länderspezifischen Regularien bestätigen. Daran wird sich auch nichts ändern, es kommen allerdings noch zusätzliche Aufgaben hinzu“. Die jeweilige CE-Konformitätserklärung für ein Produkt hat Chromsystems selbst ausgestellt, wenn es die entsprechenden Kriterien erfüllt hat und die Prozesse für die Entwicklung eines CE-IVD durchlaufen hat. „Das geht so bald nicht mehr.“, sagt Fischer.
Denn unter der neuen Verordnung durchläuft jeder Kit eine Re-Klassifizierung und Neuregistrierung, dabei gibt es die Möglichkeit einer Selbst-Zertifizierung nur noch im Ausnahmefall. Stattdessen läuft nahezu jede Zertifizierung über die benannte Stelle. Dies führt zu einer strikteren Dokumentation mit höherem Aufwand, aber auch zu einer besseren Überwachung nach dem Inverkehrbringen. Für eine verbesserte Rückführbarkeit wurden auch die so genannten „Unique Device Identification (UDI) eingeführt, die ab 2024 verpflichtend ist: für jedes Produkt ist eine UDI-Nummer erforderlich, die unter anderem auf dem Etikett zu finden ist und dafür sorgt, dass das Produkt noch besser rückverfolgbar wird.
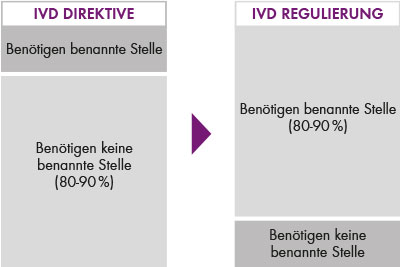

Abb. 1: Während bisher 90% aller IVDs selbst CE-deklariert waren und keine benannte Stelle involviert war, wird sich das Bild mit der neuen Verordnung bald ändern.
Mehraufwand oder Nutzen?
Lohnt sich das oder ist das einfach nur noch mehr regulatorischer Aufwand? „Was einen Nachteil für uns als Hersteller hat, das kann man kundenseitig aber durchaus auch als einen Vorteil anführen.“, meint Ralf Fischer. „Die zusätzlichen Aufgaben führen letzten Endes zu einer weiteren Qualitätssteigerung: die intensivere Verifizierung und Validierung im analytischen und diagnostischen Bereich sowie die Überwachung der von uns entwickelten, produzierten und auf den Markt gebrachten Produkte wird beispielsweise größer.“
Ein neuer Baustein ist die klinische Evidenz (Abb. 2), ein Bereich, in der die alte Regulierung bisher vergleichsweise geringe Anforderungen stellte. Vor dem Hintergrund, dass auf der Basis eines IVD-Produkts Entscheidungen zur Behandlung von Patienten getroffen werden, ist es verständlich, dass die Gesetzgeber hier aktiv wurden und der „intended use“, der medizinische Verwendungszweck einer Analysen-Methode (Kits), nun eindeutig und nachvollziehbar sein muss.
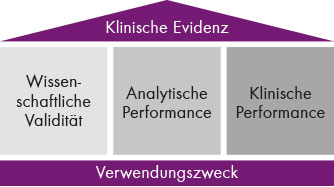

Abb. 2: Die klinische Evidenz besteht aus drei Bausteinen: wissenschaftliche Validität sowie analytische und klinische Performance.
Die klinische Evidenz ruht auf drei Säulen: wissenschaftliche Validität, analytische Performance sowie klinische Performance (siehe Abb. 2). Bei der wissenschaftlichen Validität müssen sich Hersteller wie Chromsystems einiges an Dokumentation der benannten Stelle vorlegen, die die Sinnhaftigkeit eines Tests nachweisen: wann ist die Bestimmung eines bestimmten Parameter sinnvoll, kann ich damit Krankheiten diagnostizieren und wenn ja, welche? Ist es sinnvoll für ein bestimmtes Medikament Therapeutisches Drug Monitoring durchzuführen und welchen Nachweis kann ich als Hersteller dazu erbringen? Bei manchen Parametern ist das eine einfache Sache, da es eine Vielzahl an wissenschaftlicher Literatur bereits gibt. So ist die Analyse der biogenen Amine zur Tumordiagnostik durch eine Vielzahl an Studien dokumentiert. In anderen Fällen kann das anders aussehen, wie zum Beispiel bei Stoffwechselkrankheiten. „Wenn man mit einem Assay über 40 Aminosäuren nachweisen kann, dann braucht man Studien zur Signifikanz und Sensitivität für jeden dieser Parameter und für jede der Krankheiten, die ich als Einsatzzweck mit angeben möchte. Das muss sich dann auch im vorgesehenen Verwendungszweck des Assays, dem intended use, widerspiegeln.“, sagt Ralf Fischer. „In dem legt der Hersteller fest, wofür die Laboratorien den IVD-Test eingesetzt können und wofür nicht.“
Wenn es keine Studien aus der Fachliteratur gibt und eine retrospektive Betrachtung existierender Daten und damit zusammenhängende Krankheitsbilder nicht ausreichend ist, so müssen die Hersteller diese Studien selbst durchführen, um den Nachweis zu erbringen. Das kann im Einzelfall extrem zeitaufwendig sein und einen verträglichen finanziellen Mehraufwand überschreiten. „Langfristig führt das aber generell zu einer höheren Qualität der IVDs, aber wohl auch zu einer abnehmenden Vielfalt.“, prognostiziert Fischer.
Die analytische Performance entspricht dem was viele Hersteller wie Chromsystems bereits in der Entwicklung eines Assays berücksichtigt haben. Neu ist, dass die Verordnung genau beschreibt was alles zu prüfen ist. „Das stellt kein Problem dar, da wir das sowieso schon die ganze Zeit machen. Bei der klinischen Performance sieht das schon anders aus.“
Beispiel Neugeborenen Screening
Der Neugeborenen Screening Assay von Chromsystems ist in Risiko-Klasse C eingestuft und benötigt eine Reihe von Studien, darunter auch externe Performance-Studien. Bei diesen Studien müssen etwa 1500 Realproben gemessen werden, darunter müssen sich auch Proben befinden, die für eine Vielzahl an Stoffwechselkrankheiten wie PKU, MSUD, Tyrosinämie und all diejenigen positiv sind, die man im intended use angeben möchte.
Dann muss der cut-off-Wert für jede Aminosäure und jede Krankheit so definiert werden, dass sichergestellt ist, dass der Test 0% falsch-negative Ergebnisse aber gleichzeitig ein Minimum an falsch-positiven liefert. (siehe Abb. 3). Ein Second tier-Test sorgt dann für die Bestätigungsanalytik im Fall eines positiv ausgefallenen Tests.
Möchte ein Labor das Kit, die Analysenmethode für weitere Fragestellungen einsetzen, die nicht im „intended use“, im Verwendungszweck des Kit-Herstellers aufgeführt sind, so ist das Labor in dieser konkreten Fragestellung für die medizinische und diagnostische Leistungsfähigkeit verantwortlich und in der der entsprechenden dokumentarischen Pflicht. Der Test wird quasi zu einem Lab-Developed Test (LDT).
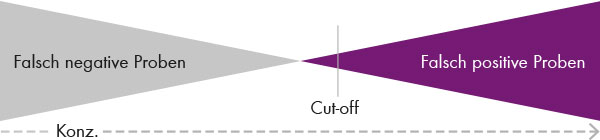

Abb.3: Beim Neugeborenen-Screening muss der Cut-off Wert so definiert sein, dass der Test 0% falsch-negative Proben und gleichzeitig möglichst wenige falsch-positive Proben liefert.
Vor- und Nachteile der neuen Verordnung
Der Aufwand für den Hersteller führt dazu, dass die Entwicklung eines IVDR-konformen Kits zwischen 1 bis 3 Jahre benötigen kann. Schnellere Prozesse sind realitätsfern und werden in der Zukunft nicht mehr darstellbar sein. Der durch die IVDR 2017 geforderte Mehraufwand bedingt außerdem eine erhebliche Zunahme der finanziellen Aufwendung, um die Produkte zur Marktreife zu führen. Allerdings sorgt dieser Aufwand für ein Maximum an Sicherheit und Zuverlässigkeit. Gerade auch die post-market surveillance ist ein Qualitätsmerkmal, das einzelne Labore vermutlich so nicht darstellen können. Ein weltweit im Markt vertretener Hersteller erkennt deutlich schneller, wenn zum Beispiel ein neu zugelassenes Medikament oder ein Metabolit zu einer Neubetrachtung und Überprüfung der Analysenmethode führt. „Wir müssen darauf schnell reagieren und den Assay entsprechend anpassen und informieren schnellstmöglich die Kunden des Assays. Da sind Inhouse-Methoden schon mal im Nachteil. Die bekommen Interferenzen eventuell erst später mit, während Kunden bei Chromsystems bereits auf ein verbessertes Produkt umgestellt haben. So lassen sich Probleme lösen noch bevor sie im Labor auftreten.“, erklärt Fischer.
Bedeutung für Medizinische Labore
Unterdessen kommt auch auf die medizinischen Labore insbesondere für die LDTs viel Arbeit zu. Der Validierungs- und Verifizierungsaufwand steigt und sie müssen grundsätzlich die gleichen Regulatorien erfüllen, wie ein Hersteller von CE-IVD-Produkten, die im Anhang 1 der Verordnung festgelegt sind (Link 2). Für selbst entwickelte Methoden bedeutet das zusätzliche Validerungsaufgaben sowie diagnostische und analytische Nachweise. Definitiv wird der dokumentarische Aufwand deutlich größer. Allein dadurch, dass Labore dokumentieren müssen, warum nicht ein kommerziell erhältlicher IVDR Kit zum Einsatz kommt, obwohl er die gleichen Leistungsmerkmale wie die Inhouse-Methode aufweist. „Diskussionen dazu finden definitiv in allen Laboren statt. Die bald verpflichtenden Aufgaben der neuen IVDR sorgen dafür, dass viele Labore mit Inhouse- Methoden auf Herstellerkits umstellen, weil es so für sie im Endeffekt günstiger wird. Andere warten noch ab.“, sagt Fischer.
Letzte Aktualisierung am 9. Juni 2021
Weitere Informationen

